Perhitungan Kimia
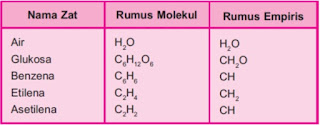
Rumus Empiris dan Rumus Molekul -Rumus Empiris (RE) Rumus empiris, rumus yang menyatakan perbandingan terkecil atom-atom dari unsur-unsur yang menyusun senyawa -Rumus Molekul (RM) Rumus molekul, rumus yamg menyatakan jumlah atom-atom dari unsur-unsur yang menyusun satu molekul senyawa Menentukan Rumus Empiris dan Rumus Molekul Rumus empiris suatu senyawa dapat ditentukan apabila diketahui salah satu dari beberapa hal berikut yaitu : -massa dan Ar tiap-tiap unsur penyusun senyawa tersebut -% massa dan Ar tiap-tiap unsur penyusun senyawa tersebut. -perbandingan massa dan Ar tiap-tiap unsur penyusun senyawa n=bilangan bulat Penentuan rumus empiris dan rumus molekul suatu senyawa dapat ditempuh dengan langkah berikut 1.Cari massa (persentase) tiap unsur penyusun senyawa 2.Ubah ke satuan mol 3.Perbandingan mol tiap unsur merupakan rumus empiris 4.Cari rumus molekul dengan cara (Mr rumus empiris)n = Mr rumus molekul, n dapat dihitung 5.Kalikan n yang diperoleh dari hitunga...
