Perhitungan Kimia
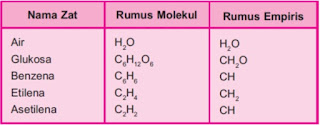
Rumus Empiris dan Rumus Molekul
-Rumus Empiris (RE)
Rumus empiris, rumus yang menyatakan perbandingan terkecil atom-atom dari unsur-unsur yang menyusun senyawa
-Rumus Molekul (RM)
Rumus molekul, rumus yamg menyatakan jumlah atom-atom dari unsur-unsur yang menyusun satu molekul senyawa
Menentukan Rumus Empiris dan Rumus Molekul
Rumus empiris suatu senyawa dapat ditentukan apabila diketahui salah satu dari beberapa hal berikut yaitu :
-massa dan Ar tiap-tiap unsur penyusun senyawa tersebut
-% massa dan Ar tiap-tiap unsur penyusun senyawa tersebut.
-perbandingan massa dan Ar tiap-tiap unsur penyusun senyawa
n=bilangan bulat
Penentuan rumus empiris dan rumus molekul suatu senyawa dapat ditempuh dengan langkah berikut
1.Cari massa (persentase) tiap unsur penyusun senyawa
2.Ubah ke satuan mol
3.Perbandingan mol tiap unsur merupakan rumus empiris
4.Cari rumus molekul dengan cara
(Mr rumus empiris)n = Mr rumus molekul, n dapat dihitung
5.Kalikan n yang diperoleh dari hitungan dengan rumus empiris
Langkah Menyelesaikan Soal Perhitungan Kimia
1.Tuliskan Persamaan Reaksi Setaranya
2.Ubahlah semua zat yang diketahui kedalam MOL
3.Carilah mol zat yang ditanyakan dengan menggunakan perbandingan koefisien reaksinya
4.Ubahlah semua zat ditanyakan dari mol ke satuan yang ditanyakan
Contoh Soal :
Al direaksikan dengan larutan H2SO4 menurut persamaan reaksi :
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
Jika 13,5 g Al yang direaksikan tentukan :
a. berapa mL larutan H2SO4 0,25 M yang diperlukan
b. berapa gram Al2(SO4)3 yang dihasilkan
c. berapa L volume gas H2 yang dihasilkan pada keadaan 27oC, 0,5 atm
Jawab :
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
13,5 g 0,25 M ? ?
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
13,5 g 0,25 M ? ?
Mol zat yang diketahui
Mol zat yang dicari
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
13,5 g 0,25 M ? ?
Zat yang dicari
Contoh Soal :
5,6 gram besi (Ar Fe = 56) dilarutkan dalam larutan HCl sesuai reaksi:
Fe(s) + HCl(aq) → FeCl3(aq) + H2(g) (belum setara)
Tentukan volume H2 yang dihasilkan pada keadaan standar (STP)!
Jawab :
Fe(s) + HCl(aq) → FeCl3(aq) + H2(g) { setarakan dahulu }
2 Fe(s) + 6 HCl(aq) → 2 FeCl3(aq) + 3 H2(g)
Pereaksi Pembatas
-Di dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yang ditambahkan tidak selalu sama dengan perbandingan koefisien reaksinya
-Hal ini menyebabkan ada zat pereaksi yang akan habis bereaksi lebih dahulu.
-Pereaksi demikian disebut pereaksi pembatas
Perhatikan Ilustrasi reaksi dibawah ini
Ternyata molekul zat Y telah habis terlebih dahulu sehingga ada molekul zat X yang tersisa. Maka zat Y dikatakan sebagai pereaksi pembatas.
Contoh Soal :
100 mL larutan Ca(OH)2 0,1 M direaksikan dengan 100 mL larutan HCl 0,1 M sesuai reaksi:
Ca(OH)2(aq) + 2 HCl(aq) → CaCl2(aq) + 2 H2O(l)
Tentukan:
a. pereaksi pembatas
b. pereaksi yang sisa
c. mol CaCl2 dan mol H2O yang dihasilkan
Jawab :
Pertama cari mol dari masing-masing zat yang diketahui
Kimia Hidrat (Air Kristal)
Hidrat adalah senyawa kristal padat yang mengandung air kristal (H2O).
Secara umum, rumus hidrat dapat ditulis sebagai berikut
X merupakan jumlah molekul air yang terikat didalam kristal hidrat.
Beberapa senyawa berhidrat
Jika suatu senyawa hidrat dipanaskan, maka ada sebagian atau seluruh air kristalnya dapat dilepas (menguap). Jika suatu hidrat dilarutkan dalam air, maka air kristalnya akan lepas
Contoh: CuSO4.5 H2O(s) → CuSO4(aq) + 5 H2O(g)
Jumlah molekul air kristal dari suatu senyawa hidrat dapat ditentukan melalui cara sebagai berikut
Contoh Soal :
Sebanyak 5 gram hidrat dari tembaga(II) sulfat (CuSO4.X H2O) dipanaskan sampai semua air kristalnya menguap. Jika massa padatan yang terbentuk adalah 3,2 gram, tentukan rumus hidrat tersebut! (Ar Cu = 63,5, S = 32, O = 16, dan H = 1)
Jawab :
Massa H2O = 5 gram – 3,2 gram = 1,8 gram
CuSO4.X H2O(s) → CuSO4(s) + X H2O(l)
CuSO4.X H2O(s) → CuSO4(s) + X H2O(l)
o,o2mol 0,1 mol
Jika perbandingan disederhanakan dengan membaginya oleh bilangan terkecil maka :
Karena perbandingan mol = perbandingan koefisien reaksi
CuSO4.X H2O(s) → CuSO4(s) + X H2O(l)
1 mol 5 mol
Maka harga X = 5 sehingga Rumus kristalnya adalah CuSO4.5H2O
-Rumus Empiris (RE)
Rumus empiris, rumus yang menyatakan perbandingan terkecil atom-atom dari unsur-unsur yang menyusun senyawa
-Rumus Molekul (RM)
Rumus molekul, rumus yamg menyatakan jumlah atom-atom dari unsur-unsur yang menyusun satu molekul senyawa
Menentukan Rumus Empiris dan Rumus Molekul
Rumus empiris suatu senyawa dapat ditentukan apabila diketahui salah satu dari beberapa hal berikut yaitu :
-massa dan Ar tiap-tiap unsur penyusun senyawa tersebut
-% massa dan Ar tiap-tiap unsur penyusun senyawa tersebut.
-perbandingan massa dan Ar tiap-tiap unsur penyusun senyawa
n=bilangan bulat
Penentuan rumus empiris dan rumus molekul suatu senyawa dapat ditempuh dengan langkah berikut
1.Cari massa (persentase) tiap unsur penyusun senyawa
2.Ubah ke satuan mol
3.Perbandingan mol tiap unsur merupakan rumus empiris
4.Cari rumus molekul dengan cara
(Mr rumus empiris)n = Mr rumus molekul, n dapat dihitung
5.Kalikan n yang diperoleh dari hitungan dengan rumus empiris
Langkah Menyelesaikan Soal Perhitungan Kimia
1.Tuliskan Persamaan Reaksi Setaranya
2.Ubahlah semua zat yang diketahui kedalam MOL
3.Carilah mol zat yang ditanyakan dengan menggunakan perbandingan koefisien reaksinya
4.Ubahlah semua zat ditanyakan dari mol ke satuan yang ditanyakan
Contoh Soal :
Al direaksikan dengan larutan H2SO4 menurut persamaan reaksi :
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
Jika 13,5 g Al yang direaksikan tentukan :
a. berapa mL larutan H2SO4 0,25 M yang diperlukan
b. berapa gram Al2(SO4)3 yang dihasilkan
c. berapa L volume gas H2 yang dihasilkan pada keadaan 27oC, 0,5 atm
Jawab :
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
13,5 g 0,25 M ? ?
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
13,5 g 0,25 M ? ?
Mol zat yang diketahui
Mol zat yang dicari
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) + 3 H2(g)
13,5 g 0,25 M ? ?
Zat yang dicari
Contoh Soal :
5,6 gram besi (Ar Fe = 56) dilarutkan dalam larutan HCl sesuai reaksi:
Fe(s) + HCl(aq) → FeCl3(aq) + H2(g) (belum setara)
Tentukan volume H2 yang dihasilkan pada keadaan standar (STP)!
Jawab :
Fe(s) + HCl(aq) → FeCl3(aq) + H2(g) { setarakan dahulu }
2 Fe(s) + 6 HCl(aq) → 2 FeCl3(aq) + 3 H2(g)
Pereaksi Pembatas
-Di dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yang ditambahkan tidak selalu sama dengan perbandingan koefisien reaksinya
-Hal ini menyebabkan ada zat pereaksi yang akan habis bereaksi lebih dahulu.
-Pereaksi demikian disebut pereaksi pembatas
Perhatikan Ilustrasi reaksi dibawah ini
Ternyata molekul zat Y telah habis terlebih dahulu sehingga ada molekul zat X yang tersisa. Maka zat Y dikatakan sebagai pereaksi pembatas.
Contoh Soal :
100 mL larutan Ca(OH)2 0,1 M direaksikan dengan 100 mL larutan HCl 0,1 M sesuai reaksi:
Ca(OH)2(aq) + 2 HCl(aq) → CaCl2(aq) + 2 H2O(l)
Tentukan:
a. pereaksi pembatas
b. pereaksi yang sisa
c. mol CaCl2 dan mol H2O yang dihasilkan
Jawab :
Pertama cari mol dari masing-masing zat yang diketahui
Kimia Hidrat (Air Kristal)
Hidrat adalah senyawa kristal padat yang mengandung air kristal (H2O).
Secara umum, rumus hidrat dapat ditulis sebagai berikut
X merupakan jumlah molekul air yang terikat didalam kristal hidrat.
Beberapa senyawa berhidrat
Jika suatu senyawa hidrat dipanaskan, maka ada sebagian atau seluruh air kristalnya dapat dilepas (menguap). Jika suatu hidrat dilarutkan dalam air, maka air kristalnya akan lepas
Contoh: CuSO4.5 H2O(s) → CuSO4(aq) + 5 H2O(g)
Jumlah molekul air kristal dari suatu senyawa hidrat dapat ditentukan melalui cara sebagai berikut
Contoh Soal :
Sebanyak 5 gram hidrat dari tembaga(II) sulfat (CuSO4.X H2O) dipanaskan sampai semua air kristalnya menguap. Jika massa padatan yang terbentuk adalah 3,2 gram, tentukan rumus hidrat tersebut! (Ar Cu = 63,5, S = 32, O = 16, dan H = 1)
Jawab :
Massa H2O = 5 gram – 3,2 gram = 1,8 gram
CuSO4.X H2O(s) → CuSO4(s) + X H2O(l)
CuSO4.X H2O(s) → CuSO4(s) + X H2O(l)
o,o2mol 0,1 mol
Jika perbandingan disederhanakan dengan membaginya oleh bilangan terkecil maka :
Karena perbandingan mol = perbandingan koefisien reaksi
CuSO4.X H2O(s) → CuSO4(s) + X H2O(l)
1 mol 5 mol
Maka harga X = 5 sehingga Rumus kristalnya adalah CuSO4.5H2O























Casino App for Android | 9 Similar Apps - JTM Hub
ReplyDeleteTry 과천 출장안마 out the 군포 출장샵 latest version of 논산 출장마사지 Casino App for Android 파주 출장안마 at JTMHub - a trusted online gambling platform offering a 목포 출장마사지 variety of safe and legal online games.