Konsep Mol
Massa Atom Relatif (Ar)
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa atom relatif sebesar 12 . Ar menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C–12. Atau dapat dituliskan:
Mencari Massa Atom Relatif (Ar) berdasarkan kelimpahan isotop
Untuk mencari Ar dapat dilakukan dengan menggunakan data kelimpahan isotop unsur yang terdapat di alam dengan persamaan :
Contoh Soal :
Unsur Galium mempunyai dua isotop yaitu Ga-69 dan Ga-71. Jika
diketahui bahwa di alam terdapat 60% Ga-69, tentukan massa atom relatif (Ar) Galium
Massa Molekul Relatif (Mr)
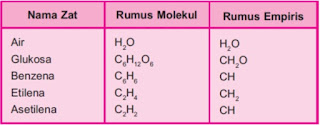
Massa molekul relatif adalah perbandingan massa molekul unsur atau senyawa terhadap 1/12 x massa atom C–12. Secara matematis dapat dinyatakan :
Jumlah Unsur dalam Senyawa
Untuk menentukan jumlah Unsur (massa atau %) dalam suatu senyawa dapat ditentukan dengan menggunakan persamaan :
Contoh Soal
Dalam 50 g CaCO3 ? (Ar: C = 12; O= 16; Ca=40) tentukan
a. massa Ca dalam Senyawa
b. kadar C dalam senyawa
Jawab :
JUMLAH PARTIKEL
Dalam satu mol suatu zat terdapat 6,022 x 1023 partikel.
Nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N.
Partikel yang dimaksud dapat berupa atom, molekul atau ion.
Contoh Soal
-Tentukan mol dari :
3,01x1021 atom Fe
-Tentukan mol dari :
1,204x1022 molekul NaCl
-Tentukan partikel dari :
0,25 mol Na
-Tentukan partikel dari :
1,25 mol MgS
Massa Molar
Massa satu mol zat dinamakan massa molar.
Besarnya massa molar zat adalah massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol
Contoh Soal
-Tentukan mol dari :
135 gram Al (Ar 27)
-Tentukan mol dari :
10 gram CaCO3 (Ar Ca = 40, C=12, O = 16)
-Tentukan massa dari :
0,25 mol Zn (Ar = 65)
-Tentukan massa dari :
1,25 mol MgS (Ar Mg = 24 S=32)
Volume Molar
Volume satu mol zat dalam keadaan Standar dinamakan Volume molar.
Besarnya volume molar gas adalah volume gas pada keadaan standar yang dinyatakan dalam satuan Liter per mol
STP = 0oC, 1 atm RTP = 25oC, 1 atm
Contoh Soal
-Tentukan mol dari :
6 L gas O2 (RTP)
-Tentukan mol dari :
6,72 L gas H2S (STP)
-Tentukan volume dari :
0,25 mol gas CO2 (STP)
-Tentukan volumedari :
1,25 mol gas CH4 (RTP)
Volume gas Pada Keadaan Tidak Standar
Jika gas tidak berada pada keadaan STP ataupun RTP, maka untuk menentukan volume nya dapat dipergunakan persamaan
Jika diketahui Suhu dan Tekanannya
P = Tekanan (atm), R= 0,082(tetapan) , T = suhu (Kelvin)
Jika diketahui pada P dan T yang sama, volume dan massa gas yang lain.
Contoh Soal
-Tentukan volume dari 0,05 mol gas O2 pada keadaan 127oC , 38 cmHg
-Tentukan volume 0,2 mol gas NH3 , jika pada P dan T yang sama 8 gram gas SO3 mempunyai volume 5 L.
Molaritas/Molar (M)
Molaritan/Molar adalah banyaknya zat yang terdapat dalam 1 Liter larutan.
Satuan dari Molaritas adalah mol/Liter atau Molar
Contoh Soal Molaritas
-Tentukan molaritas dari 0,5 mol NaCl dalam 100 ml larutan
-Tentukan molaritas dari 7,8 gram Na2S dalam 2 Liter Larutan
-Tentukan mol zat dari 250 mL larutan MgSO4 0,2 M
-Tentukan massa zat dari 500 ml larutan H2SO4 0,1 M
Contoh Soal Konversi mol
-Tentukan jumlah partikel dari 216 gram Ag (Ar Ag = 108)
-Tentukan massa dari 6,72 L gas CS2 (STP) (Ar C = 12, S = 32)
-Tentukan volume dari 6,02.1022 molekul gas CO2 (RTP)
Para ahli menggunakan isotop karbon C–12 sebagai standar dengan massa atom relatif sebesar 12 . Ar menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C–12. Atau dapat dituliskan:
Mencari Massa Atom Relatif (Ar) berdasarkan kelimpahan isotop
Untuk mencari Ar dapat dilakukan dengan menggunakan data kelimpahan isotop unsur yang terdapat di alam dengan persamaan :
Contoh Soal :
Unsur Galium mempunyai dua isotop yaitu Ga-69 dan Ga-71. Jika
diketahui bahwa di alam terdapat 60% Ga-69, tentukan massa atom relatif (Ar) Galium
Massa Molekul Relatif (Mr)
Massa molekul relatif adalah perbandingan massa molekul unsur atau senyawa terhadap 1/12 x massa atom C–12. Secara matematis dapat dinyatakan :
Jumlah Unsur dalam Senyawa
Untuk menentukan jumlah Unsur (massa atau %) dalam suatu senyawa dapat ditentukan dengan menggunakan persamaan :
Contoh Soal
Dalam 50 g CaCO3 ? (Ar: C = 12; O= 16; Ca=40) tentukan
a. massa Ca dalam Senyawa
b. kadar C dalam senyawa
Jawab :
JUMLAH PARTIKEL
Dalam satu mol suatu zat terdapat 6,022 x 1023 partikel.
Nilai 6,022 x 1023 partikel per mol disebut sebagai tetapan Avogadro, dengan lambang L atau N.
Partikel yang dimaksud dapat berupa atom, molekul atau ion.
Contoh Soal
-Tentukan mol dari :
3,01x1021 atom Fe
-Tentukan mol dari :
1,204x1022 molekul NaCl
-Tentukan partikel dari :
0,25 mol Na
-Tentukan partikel dari :
1,25 mol MgS
Massa Molar
Massa satu mol zat dinamakan massa molar.
Besarnya massa molar zat adalah massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol
Contoh Soal
-Tentukan mol dari :
135 gram Al (Ar 27)
-Tentukan mol dari :
10 gram CaCO3 (Ar Ca = 40, C=12, O = 16)
-Tentukan massa dari :
0,25 mol Zn (Ar = 65)
-Tentukan massa dari :
1,25 mol MgS (Ar Mg = 24 S=32)
Volume Molar
Volume satu mol zat dalam keadaan Standar dinamakan Volume molar.
Besarnya volume molar gas adalah volume gas pada keadaan standar yang dinyatakan dalam satuan Liter per mol
STP = 0oC, 1 atm RTP = 25oC, 1 atm
Contoh Soal
-Tentukan mol dari :
6 L gas O2 (RTP)
-Tentukan mol dari :
6,72 L gas H2S (STP)
-Tentukan volume dari :
0,25 mol gas CO2 (STP)
-Tentukan volumedari :
1,25 mol gas CH4 (RTP)
Volume gas Pada Keadaan Tidak Standar
Jika gas tidak berada pada keadaan STP ataupun RTP, maka untuk menentukan volume nya dapat dipergunakan persamaan
Jika diketahui Suhu dan Tekanannya
P = Tekanan (atm), R= 0,082(tetapan) , T = suhu (Kelvin)
Jika diketahui pada P dan T yang sama, volume dan massa gas yang lain.
Contoh Soal
-Tentukan volume dari 0,05 mol gas O2 pada keadaan 127oC , 38 cmHg
-Tentukan volume 0,2 mol gas NH3 , jika pada P dan T yang sama 8 gram gas SO3 mempunyai volume 5 L.
Molaritas/Molar (M)
Molaritan/Molar adalah banyaknya zat yang terdapat dalam 1 Liter larutan.
Satuan dari Molaritas adalah mol/Liter atau Molar
Contoh Soal Molaritas
-Tentukan molaritas dari 0,5 mol NaCl dalam 100 ml larutan
-Tentukan molaritas dari 7,8 gram Na2S dalam 2 Liter Larutan
-Tentukan mol zat dari 250 mL larutan MgSO4 0,2 M
-Tentukan massa zat dari 500 ml larutan H2SO4 0,1 M
Contoh Soal Konversi mol
-Tentukan jumlah partikel dari 216 gram Ag (Ar Ag = 108)
-Tentukan massa dari 6,72 L gas CS2 (STP) (Ar C = 12, S = 32)
-Tentukan volume dari 6,02.1022 molekul gas CO2 (RTP)








































Comments
Post a Comment